O. Hampel, R. Beckert*
Prof. Dr. R. Beckert
Institut fuer organische Chemie FSU-Jena Humboldtstr. 10 07743 Jena c6bera@rz.uni-jena.de
Einleitung:
Achsenchirale Verbindungen haben in den letzten zwei Jahrzehnten eine besondere Bedeutung in der organischen Chemie erlangt. Sie dienen u.a. als Liganden mit hoher chiraler Induktion bei der asymmetrischen Synthese. In diesem Zusammenhang haben sich besonders Stoffe mit einer Binaphthylsubstruktur bewaehrt. (Rosini, Franzini, Rafaelli, Salvadori; Synthesis; 503; (1992)) Ermutigt durch unsere Erfolge bei der Herstellung des achsenchiralen 2,2'-Diisothiocyanato-1,1'-binaphthyls (J. Atzrodt, R. Beckert, A. Darsen; Tetrahedron Asymm.; 8; 2257; (1997)) testeten wir diese Verbindung bei der Umsetzung mit Aminen und konnten eine Reihe von interessanten Verbindungen herstellen (O. Hampel, R. Beckert, B. Schoenecker, M. Rost, M. Kötteritsch, H. Görls; Sulfur Letters; 24; 39-50; (2000)). Wir beschreiben im Folgenden weitere neuartige Verbindungen der allgemeinen Formel 2.
Hauptteil:
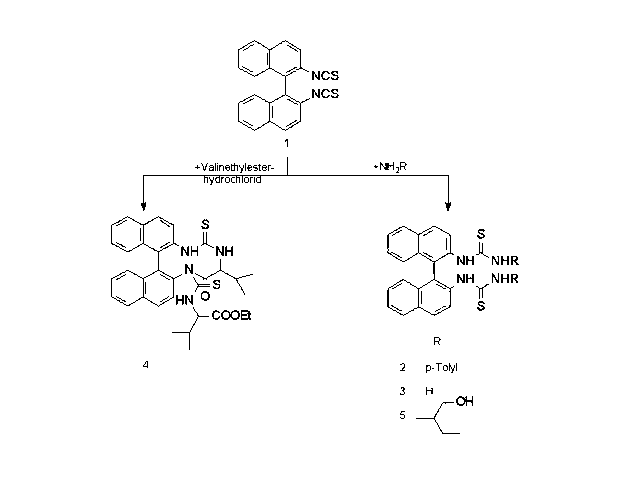
2,2'-Diisothiocyanato-1,1'-binaphthyl 1 reagiert bereitwillig mit den meisten Aminen, wobei sekundaere Amine hinsichtlich ihres Reaktionsvermoegens eine herausragende Stellung einnehmen (O. Hampel, R. Beckert, B. Schoenecker, M. Rost, M. Kötteritsch, H. Görls; Sulfur Letters; 24; 39-50; (2000)). Primaere Amine wie z.B.: p-Toluidin zeigen ebenfalls ein ausgepraegtes Reaktionsvermoegen gegenueber 1. Es konnte ausnahmslos nur die Bildung des Bisthioharnstoffes 2 diagnostiziert werden, was nicht weiter verwundert, da die Binaphthyleinheiten um etwa 90° diamedral verdreht vorliegen und daher ein cyclisches Produkt eher unwahrscheinlich ist. Ebenso reagiert Ammoniak, welcher als wässrige Ammoniaklösung eingesetzt wurde, zu dem Thioharnstoff der Struktur 3. Die Struktur wurde mittels Semiempirischen Methoden (AM1 bzw. PM3) berechnet und via NMR und MS gesichert. (O. Hampel; MS-Thesen an der FSU-Jena; 5; (1998)) Von besonderer Bedeutung war die Umsetzung mit chiralen Verbindungen, um auf diese Weise eine Enantiomerentrennung der Ausgangsverbindung zu ermoeglichen. In Betracht kamen zunaechst chirale Aminosäuren, da ihre Reaktivitaet gegenueber einfachen Senfoelen bereits literaturbekannt war. (Wieland, Mueller, Niemnn, Birkhofer, Schoeberl, Wagner, Soell; Houben Weyl; 4. Aufl.; XI/2; Ed.: Mueller; Thieme Verlag, Stuttgart; 368; (368)) Leider erwiesen sich diese Untersuchungen als nicht zufriedenstellend, da nur niedrige Ausbeuten erzielt werden konnten und sich das Produkt bei der Aufarbeitung zersetzte. In mehreren Versuchen konnte dennoch genug Produkt isoliert werden, um eine Charakterisierung durchzufuehren. Diese ergab, dass stets nur eine Hydantoinstruktur gebildet wurde. Aus den MS-Daten geht hervor, dass es sich um die Struktur 4 handelt, bei der die Hydantoinsubstruktur unter Einbeziehung beider funktioneller Gruppen des Isothiocyanates ausgebidlet wurde. Die Umsetzung mit R-Aminobutanol erfolgte glatt zu dem Thioharnstoff 5, falls man bei Raumtemperatur arbeitet. Erfolgt die Reaktion hingegen bei erhöhter Temperatur, so wird ein breites Produktspektrum gebildet, und zwar unter Einbeziehung der Alkoholfunktion. Keinerlei Reaktion zeigte sich bei der Umsetzung mit Aminophenolen, Diaminoethan, Diphenyldiaminoethan, Diaminocyclohexan, Diaminobenzenen, 1,3-Diaminopropan, 1,4-Diaminobutan, 1,8-Diaminooctan, 1,10-Diaminodecan, BINAM, Cysteamin, o-Methoxybenzamid, Harnstoff, Thioharnstoff.
Experimenteller Teil:
Alle Reagentien sind von kommerzieller Qualitaet (Aldrich, Fluka, Merck). Die Reaktionen wurden mittels Duennschichtchromatographie ueberwacht: Polygram SIL G/UV254 (Machery-Nagel). Saeulenchromatographische Reinigung: Silica gel 60, 0.040-0.063 mm (Merck). Schmelzpunkte: Galen III, nach Boetius (Cambridge Instruments) (Angabe in °C). NMR: DRX 400, 400 MHz; AC 250, 250 MHz (Bruker) alle Messungen erfolgten in deutereierten Lösungsmitteln (Angabe der Kopplungskonstanten in Hz). MS: MATSAQ 710 (Finnigan) (Angaben in m/e (%)). IR: IR-Spektrometer ATR-Technik (Nicolet) (Angaben in 1/cm).
Allg. Arbeitsvorschrift:
0.1g 2,2'-Disithiocyanato-1,1'-binaphthyl 1 (2,7*10exp-4 mol) werden in einem geeigneten Lösungsmittel (Ethanol, Tetrahydrofuran oder Nitromethan) geloest und mit der entsprechenden Menge des korrespondierenden Amins versetzt. Nach beendeter Reaktion destilliert man das Lösungsmittel unter verminderten Druck ab und reinigt das erhaltene Produkt durch Saeulenchromatographie.
2,2'-Di((N'-4-methylphenyl)thioureato)-1,1'-binaphthyl 2
(19 % Ausbeute) m.p.: 145
MS (CI): 583 (5) [M+1]; 476 (6); 369 (20); 327 (10); 108 (100)
IR: 3360 (NH); 3136 (CH); 2952 (Me); 1622, 1588, 1510 (C=C); 1229 (C=S)
H-NMR in Dimethylsulfoxid: 9.55 (s, NH, NH); 8.05 (t, J= 7.0, 2H); 7.88 (d, J= 8.0, 2H); 7.52 (t, J= 6.3, 2H); 7.32 (d, J= 6.0, 2H); 7.17 (d, J= 8.0, 2H); 7.05 (d, J= 8.0, 2H); 6.82 (d, J=6.0, 4H); 6.40 (d, J= 6.0, 4H); 2.16 (s, 6H, Me)
C-NMR: 179.2 (CS); 137.2, 136.4, 135.3, 134.1, 131.7, 128.6 (arom. C quart.); 129.8, 129.0, 127.8, 127.6, 126.4, 125.8, 123.7, 120.6 (arom. C); 20.4 (Me)
2,2'-Dithioureato-1,1'-binaphthyl 3
(31% Ausbeute) m.p.: 167 MS (FAB): 403 (63) [M+1]; 386 (20); 336 (100); 317 (77); 287 (70)
IR: 3265 (NH); 3160 (NH); 1594, 1529, 1510 (C=C); 1268 (C=S)
H-NMR in Dimethylsulfoxid: 8.80 (s, 2H, NH); 8.04 (d, J= 10.0, 2H); 8.00 (d, J= 7.5, 2H); 7.78 (d, J= 10.0, 2H); 7.5-7.0 (m, 10H, arom. H+NH)
C-NMR: 181.8 (C=S); 136.0, 132.5, 131.5, 128.9 (arom. C quart.); 128.3, 128.2, 127.8, 126.7, 126.4, 125.7 (arom. C)
2-(N-cyclo-(1,3-diaza-2-thio-5-oxo-4-(2propyl))-pentyl-2'-N'-2-(3,3-dimethylpropansaeuremethyleseter)-thioureato)-1,1'-binaphthyl 4
(9% Ausbeute) m.p.: 122
MS (CI): 599 (40) [M+1]; 468 (18); 426 (10); 313 (15); 132 (100)
IR: 3213 (NH); 2961; 2929; 2873 (CH/Me); 1730 (C=O); 1594; 1502 (C=C); 1254 (C=S)
H-NMR in Chloroform: 8.26 (s, 1H, NH); 8.05 (d, J= 7.8, 2H); 7.94 (d, J= 4.9, 2H); 7.78 (t, J= 8.4, 2H); 7.53 (t, J= 8.1, 2H); 7.29-7.22 (m, 5H); 6.36 (d, J= 8.4, 1H, NH); 4.88 (m, 1H, CH); 4.20 (m, 1H, CH); 3.89 (m, 1H, CH); 3.70 (m, 2H, CH); 3.66 (s, 3H, Ester); 0.92-0.70 (m, 6H, Me); 0.41 (m, 3H, Me); 0.06 (m, 3H, Me)
C-NMR: 183.3, 180.7, 173.5, 172.1 (C=S/C=O); 134.7-124.8 (arom. C); 64.9, 62.1 (CH-N); 52.0 (me-Ester); 30.4, 29.7 (CH-C); 18.5, 18.3 (Me)
2,2'-Di-(N'-2Butyl-1ol)-thioureato-1,1'-binaphthyl 5
(73% Ausbeute) m.p.: 140
MS (FAB): 547 (80) [m+1]; 458 (30); 439 (30); 336 (100)
IR: 3223 (NH/OH); 2927 (ME); 1599, 1526, 1503 (C=C); 1275 (C=S)
H-NMR in Chloroform: 9.22 (s, 2H, NH); 8.20 (d, J= 8.9, 2H); 8.00 (d, J= 7.8, 2H); 7.91 (t, J= 8.8, 2H); 7.40 (t, J= 7.4, 2H); 7.23 (d, J= 6.2, 2H); 7.15 (d, J= 7.1, 2H); 6.86 (d, J= 8.4, 2H, NH); 4.67 (m, 2H, OH); 4.06 (m, 2H, CH); 3.19 (m, 4H); 1.16 (m, 4H); 0.60 (m, 6H, Me)
c-NMR: 182.3 (C=S); 137.8, 137.0, 133.7, 131.4 (arom. C quart.); 129.0, 128.2, 127.8, 126.4, 125.7, 125.4 (arom. C); 65.7 (Methylen-OH); 60.4 (CH); 23.5 (Methylen-C); 11.1 (Me)